在神经退行性疾病的研究领域,阿尔茨海默病(AD)如同一场无声的风暴,逐渐侵蚀着患者的记忆与思维。随着我们对这一疾病病理机制的深入探索,那些曾经难以触及的治疗靶点又取得了怎样的进展呢?让我们一同走进AD研究的前沿,了解Tau靶向治疗的新动态。
Tau蛋白概述
研究表明,在AD患者体内,Tau蛋白可能经历多种异常的翻译后修饰(PTMs),这些包括磷酸化、泛素化、乙酰化和截断等。异常的PTMs使得Tau蛋白在细胞内发生错误定位和异常聚集,从而导致线粒体功能障碍、突触可塑性受损、神经胶质增生及神经炎症,最终引发神经退行性病变和认知功能障碍。此外,Tau蛋白在其他多种神经退行性疾病中也存在,如行性核上性麻痹(PSP)、皮质基底节变性(CBD)等,从而使其成为针对神经退行性疾病治疗的强有力靶点。
Tau蛋白的结构与功能
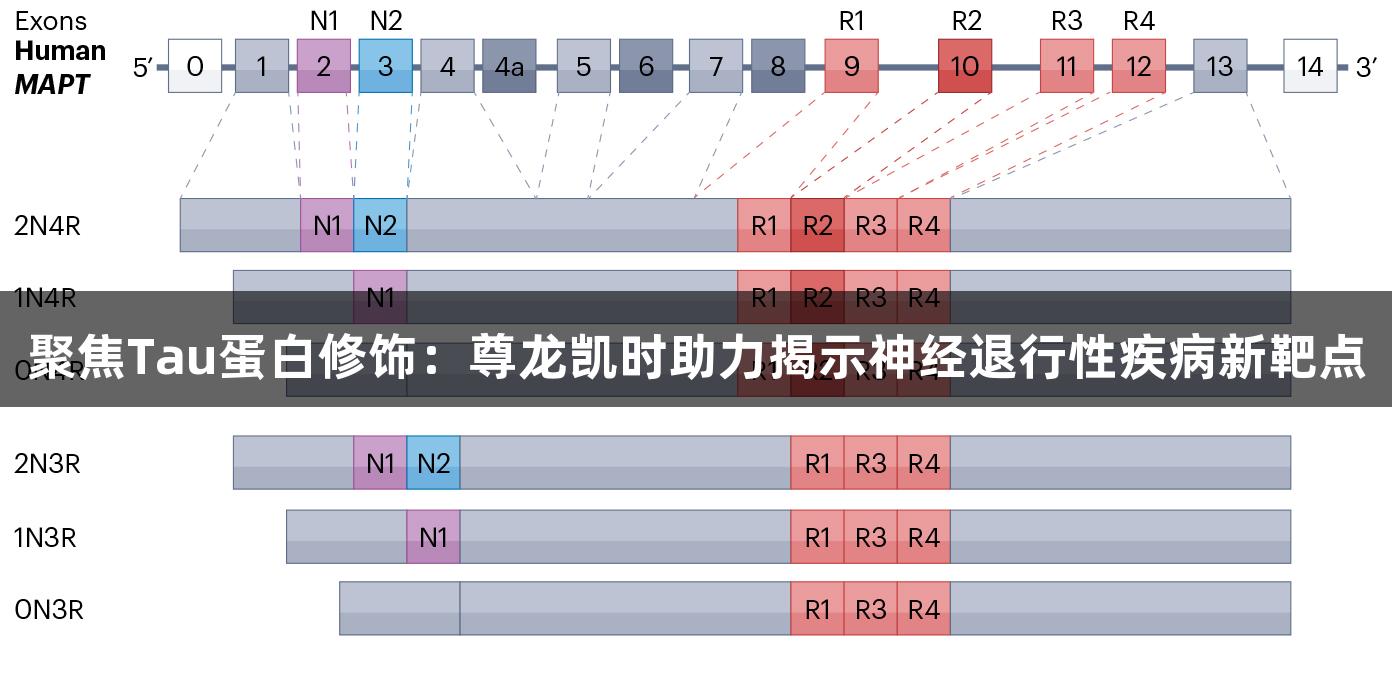
Tau蛋白于1975年首次被发现,主要存在于中枢神经系统的神经元轴突中,负责促进微管的组装和维护微管网络。Tau蛋白由17号染色体(17q21-q22)上的MAPT基因编码,具有6种异构体,分别对应不同的功能。健康成人大脑中的3R与4R异构体的比例接近1:1,但在原发性Tau蛋白病中,该比例会发生改变。
Tau翻译后修饰与病理机制
Tau磷酸化
Tau蛋白的磷酸化是研究最为深入的PTM之一。在生理过程中,磷酸化调控Tau对微管的亲和力,影响其组装和稳定性。多项研究发现,AD患者大脑中多种激酶,如GSK-3β和CDK5,表达增高,导致Tau蛋白的过度磷酸化。
Tau乙酰化
Tau蛋白的乙酰化主要发生于富含脯氨酸结构域的区域,相关的乙酰转移酶包括P300乙酰转移酶(HAT)。乙酰化修饰可影响Tau的稳定性及聚集,抑制Tau的降解,并影响认知功能。
Tau泛素化
泛素化是一个酶促过程,涉及将泛素转移到Tau蛋白的赖氨酸残基上。这一过程通过促进Tau的降解,在神经退行性疾病中起到复杂的作用,调控Tau的聚集与功能。
Tau SUMO化
SUMO化涉及将SUMO蛋白连接到Tau的特定赖氨酸残基上,这在AD患者中与泛素化竞争,抑制Tau的降解。因此,针对Tau的SUMO化可能成为潜在的治疗策略。
Tau截断
在多种Tau蛋白的疾病中,Tau的截断现象显著,表明其在Tau聚集和神经退化过程中的重要性。截断的Tau蛋白能够增强聚集,并对神经细胞造成毒性。
Tau作为靶向治疗的关键
当Tau蛋白发生异常翻译后修饰时,容易形成神经纤维缠结,导致神经细胞死亡,从而加剧多种神经退行性疾病的发展。因此,针对Tau蛋白的各种翻译后修饰为治疗提供了多个靶点。
总结与展望
靶向Tau治疗的进展虽未如人们期待的那般迅速,但其在细胞内的定位、结构及其复杂性使得其成为一个极具挑战性的靶点。未来研究将持续探索Tau蛋白的功能机制及其在多种疾病中的作用,以期为相关疾病的诊断和治疗提供新的策略和方法。在这条探索的道路上,尊龙凯时将不断努力,为神经退行性疾病的研究和疗法发展贡献力量。


